针刺不同穴位对下丘脑外侧区胃扩张敏感神经元电活动的影响
近些年, 随着人们生活水平不断提高, 其饮食结构变得复杂且多样化, 伴随生活节奏的加快, 使得胃肠疾病如便秘、腹泻、肠易激综合征等, 已成为影响人们生活品质的一个重要因素[1,2]。既往诸多研究证实, 针灸对胃肠功能具有良好的调节作用[3,4]。对其机制研究也取得了一定进展, 如与外周自主神经、肠神经系统等密切相关[5,6], 不同部位的腧穴在接受到刺激后, 通过外周自主神经逐级传入中枢, 通过整合再经由神经或体液等途径调节靶器官。由此可见, 中枢机制是影响针灸效应关键环节之一。然而, 对于高级中枢整合以及信号传递神经通路当前的研究还很局限。在调节胃肠功能的诸多核团中, 诸多研究表明下丘脑外侧区 (lateral hypothalamus area, LHA) 广泛参与胃的各种机能, 如胃的运动、胃酸的分泌、胃黏膜血流量等[7,8]。鉴于LHA在胃肠功能中枢调控中的重要作用, 本研究通过观察胃扩张和针刺不同部位特定腧穴对LHA神经元自发放电活动的影响, 以此探究LHA是否参与针刺调节胃运动的中枢整合及其效应规律特征, 为针刺调节机制研究提供新的方向。
材料与方法
1.动物
SPF级健康雄性成年SD大鼠176只, 体质量250~350g, 南京医科大学实验动物中心提供, 许可证号:SCXK (苏) 2013-0005。分批饲养于南京中医药大学实验动物中心并依照SPF级标准喂养, 室温 (22±2) ℃, 光照时间08:00~20:00, 自由饮水进食。所有实验操作严格遵循《关于善待实验动物的指导性意见》。
2.试剂与仪器
乌拉坦 (化学纯, 上海青析化工科技有限公司, 批号:70120) , 滂胺天蓝 (Sigma, 美国, 批号:2610-05-01) ;无水乙酸钠 (0.5mmol/L, 分析纯, 南京化学试剂有限公司, 批号:127-09-3) ;液状石蜡。脑立体定位仪 (David Kopf Instruments, 美国) ;微电极操作器控制 (NARISHIGE, 日本) ;细胞外电生理记录放大器 (A-M systmes, 美国) ;Micro3-1401生理信号采集分析系统 (CED, 英国) ;温控仪 (H-KWDY-Ⅲ, 南京市泉水教学实验器材厂) ;牙科钻 (ALC-CED6, 上海) ;玻璃微电极拉制仪 (WD-1, 成都仪器厂) ;玻璃微电极 (长度100mm, 外径1.2mm, 南京市泉水教学实验器材厂) ;针灸针 (0.30mm×25mm, 苏州医疗用品厂) 。
3.胃扩张 (gastric distention, GD) 手术
禁食12h后, 20%的乌拉坦 (0.8g/kg) 腹腔注射麻醉, 仰卧并颈部正中切开, 行气管插管保持呼吸通畅, 上腹部剃毛, 于剑突下腹正中线偏左侧5mm一字切口打开腹腔, 温和的0.9%氯化钠溶液纱布推开肝脏暴露胃幽门部及十二指肠上段, 于胃幽门下5~10mm处避开肠壁上可见的血管做2mm左右的一字型切口, 将带聚乙烯管的球囊放入胃体内, 荷包缝合固定, 与血压计、10mL注射器针筒相连。手术结束后将大鼠俯卧, 行LHA细胞外记录手术。当记录到稳定的LHA神经元放电后, 以注射器向球囊内打气至血压计读数到30mmHg, 扩张持续30s后迅速抽出气体, 使血压计读数归零。
4.核团定位
将麻醉大鼠俯卧固定于脑立体定位仪上, 行常规开颅术, 暴露前后囟并调至同一水平面。根据Paxions G等[9]大鼠脑立体定位图谱, LHA坐标为前卤 (AP) :-2.3~-2.8mm, 左侧 (L) :1.5~2.0mm, 脑表面下深度 (H) :7.5~9.0mm。在其上方用牙科钻开颅, 用手术显微剪和手术显微镊剥离硬脑膜暴露脑组织, 并用液状石蜡覆盖防止干燥以备记录神经元放电活动。实验过程中, 用电热板维持动物体温于 (37±0.5) ℃。手术完成后, 休息30min以待各项指标稳定。
5.LHA神经元放电记录
采用自制玻璃微电极 (尖端直径1~2μm, 电阻约10~20mΩ, 中心管内注入含2%滂胺天蓝的0.5mol/L醋酸钠电解液) , 通过微电极操作器控制到达目标核团, 探查神经元放电, 进行细胞外记录10-[10,11,12]。实验过程中只对放电幅度稳定在同一水平的信号且信噪比>3/1的神经元放电信号进行记录。干预前记录1min作为基线对照, 干预后待神经元自发放电稳定恢复至正常后再行下一次干预。
6.针刺方法
足三里 (ST 36) 、曲池 (LI 11) 、胃俞 (BL21) 和中脘 (CV 12) , 针刺时均取左侧。为排除针刺穴位顺序对结果的影响, 穴位随机排序。针刺手法为手针, 平补平泻, 捻转120~180次/min, 每穴刺激1min, 待神经元放电背景恢复正常后, 再进行下一个穴位的刺激。
7.组织学定位
每次实验结束后, 刺激器向玻璃微电极通以逆向直流电 (10μA, 20min) 将玻璃微电极中的滂胺天蓝染料微量电渗析到电极尖端的记录点, 随后取脑, 用10%福尔马林溶液固定, 1周后用冰冻切片机制备60~80μm厚的脑切片, 检查记录点位置。凡实际记录点偏离LHA者, 所获得的数据不予以记录。
8.观察指标及数据采集
记录的LHA神经元放电信号经前置放大器放大后, 输入多道生理信号采集系统使用Spike 2软件系统进行数据采集及分析, 以放电频率 (spikes/s) 为观测指标, 通过比较干预反应时间内神经元放电频率与干预前神经元基础放电频率, 计算放电频率变化率, 判断神经元反应, 并作干预前后频率直方图。放电频率变化率 (%) = (干预时-干预前) /干预前×100%。频率变化率的绝对值≥15%视为兴奋/抑制, <15%为无变化。
9.统计学方法
采用SPSS 17.0统计学软件进行统计分析, 计量资料以±s表示, 干预前后比较采用配对t检验, 计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
结果
1.神经元数据统计
通过上述实验方法排除多次定位未记录到神经元放电的数据, 对于完整记录1个循环 (基线-针刺-恢复) 数据的相应大鼠进行核团定位, 根据脑冠状切面图 (Bregma-2.4mm) 标识的LHA位点即红色区域 (图1A) , 观察脑组织切片蓝染点是否偏离核团位置 (图1B) , 此相关数据进行最终统计分析, 结果表明, 176只大鼠共记录到自发放电的LHA神经元360个。
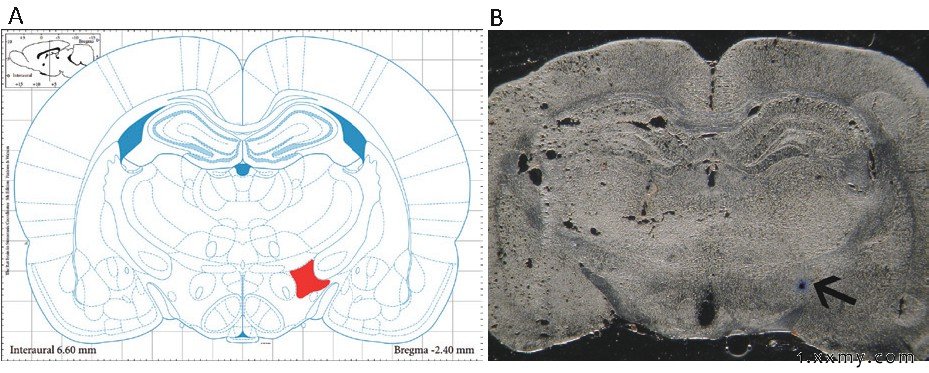
图1 LHA脑组织定位示图
注:A为组织重建图示冠状切面LHA所在位置 (Bregma-2.4mm) , 图中红色区域;B为脑组织切片图, 黑色箭头所指蓝染处为LHA记录点。
2.GD对LHA神经元自发放电的影响
给予GD干预后, 其中无反应神经元共62个, 平均放电频率为 (6.387±0.38) spikes/s, GD敏感神经元共298个, 其中GD兴奋性神经元174个, 平均放电频率为 (9.131±0.53) spikes/s, GD抑制性神经元124个, 平均放电频率为 (4.41±0.31) spikes/s, 与GD前比较差异均具有统计学意义 (P<0.01) 。见图2。
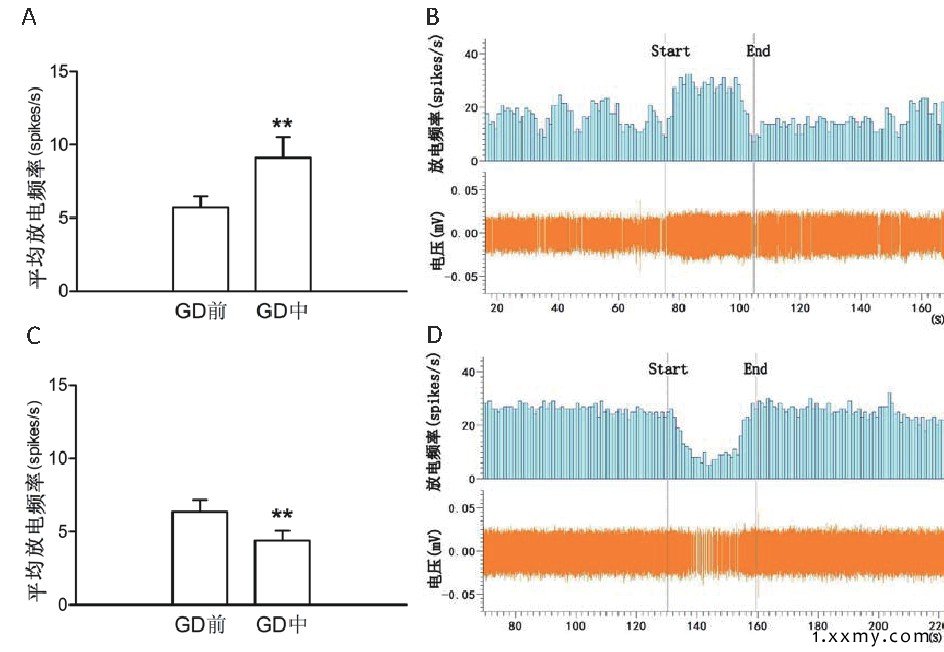
图2 GD对LHA神经元自发放电的影响
注:A.GD对LHA神经元自发放电的兴奋效应;B.GD兴奋作用示意图;C.GD对LHA神经元自发放电的抑制效应;D.GD抑制作用示意图。与GD干预前 (Pre-GD) 比较, **P<0.01。
3.不同穴位对GD敏感神经元放电活动比较
对记录到GD敏感性神经元, 给予针刺足三里 (n=86) 、曲池 (n=82) 、胃俞 (n=72) 和中脘 (n=58) 刺激, 结果表明, 4个穴位的针刺信号对LHA神经元自发放电的影响为兴奋和抑制两种形式。其中, 足三里对GD兴奋性神经元有兴奋作用趋势, 而对GD抑制性神经元有显著地抑制效应 (P<0.01) 。此外, 胃俞对GD兴奋性神经元有显著地兴奋效应 (P<0.01) , 对GD抑制性神经元有显著地抑制效应 (P<0.01) 。曲池和中脘对GD敏感神经元主要以兴奋作用为主。
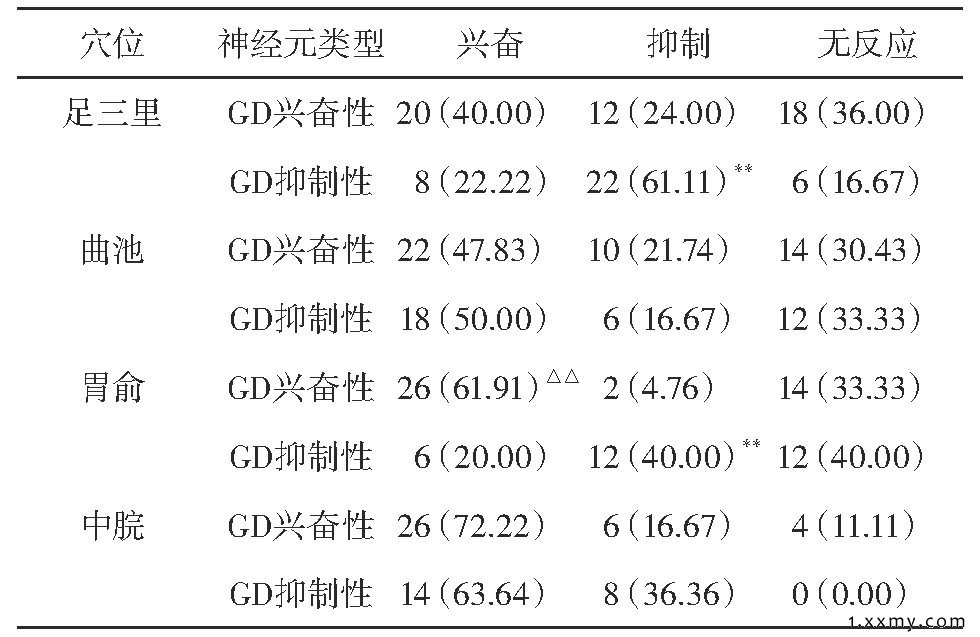
表1 针刺对LHA中GD敏感性神经元的比较[例 (%) ]
注:与同穴位GD兴奋性神经元比较, **P<0.01;与同穴位GD抑制性神经元比较, △△P<0.01。
讨论
本研究结果表明, GD信号可以传至LHA并影响其神经元放电。LHA在下丘脑调控中具有重要作用, 下丘脑作为边缘系统的重要组成部分, 与中枢神经系统的其它部位具有密切的相互联系, 既具有神经内分泌功能, 又参与自主神经的控制, 是调控胃运动的重要中枢核团之一[13,14]。进一步分析发现, GD刺激后, LHA神经元放电呈现不同的效应规律, 即呈兴奋和抑制两种类型, 依次视为GD兴奋性神经元和GD抑制性神经元。可见, LHA在参与调节胃肠运动时, 可能与GD神经元的敏感性密切相关。有学者通过细胞外放电记录方法发现, 电刺激LHA可以加强胃运动频率和幅度, 其效应与GD敏感神经元相关[15]。另有研究证实一种厌食肽nesfatin-1可影响大鼠GD敏感神经元放电活动及胃运动, 且该作用受LHA调控[16]。因此, 不同类型的GD神经元在LHA调节作用中发挥重要作用, 细化分析其效应规律对于认识LHA具有重要作用。
在此基础之上, 通过定位观察LHA神经元自发放电频率, 比较针刺位于躯体不同部位的4个穴位足三里 (下肢) 、曲池 (上肢) 、胃俞 (背部) 及中脘穴 (腹部) 对LHA神经元放电频率的影响, 目的在于探析针刺信号是否传入LHA、不同部位穴位之间产生的效应是否存在差异。实验过程中, 为降低不同腧穴之间的影响, 每次针刺后需等待神经元放电恢复正常, 稳定放电一段后, 再次重新记录新的基线。对于完整记录到基线-针刺-恢复过程的数据方可进行统计分析。结果表明针刺信号可传至LHA, 且其对LHA神经元自发放电的影响同样呈兴奋和抑制两种效应趋势。结合GD敏感性神经元放电规律进一步分析发现, 胃俞对GD抑制性神经元具有抑制作用, 对GD兴奋性神经元具有兴奋作用, 而足三里只对GD抑制性神经元具有抑制作用。此外, 曲池和中脘对不同类型LHA神经元均发挥兴奋作用。可见, 不同部位的4个腧穴对LHA具有各自的效应趋势, 这可能与腧穴的特异性有关[17], 其中胃俞对LHA具有优势调节作用。胃俞, 归足太阳膀胱经, 是胃的背俞穴。
背俞穴是脏腑经络之气输注背部的部位, 与脏腑密切相关, 在临床治疗中, 其应用广泛, 受到历代医家重视[18,19]。当前诸多研究发现背俞穴其位置的分布与脊神经阶段性分布规律十分相似, 大量的临床报道也证实, 内脏出现病变后可在背部表现出不同的病理反应[20,21]。可见, 背俞穴既是某些内脏疾病的反应点也是针刺治疗的刺激点。诸多临床报道也表明[22,23], 胃俞可增强胃蠕动, 改善胃电节律, 在治疗胃肠道消化系统疾病如胃痛、恶心、呕吐等, 其疗效显著, 具有优势调节作用。本研究结果表明, 胃俞对胃腑的特异性调节, 可能与其对LHA调节效应有关。内脏和体表神经传入在脊髓水平汇聚, 经延髓、脑干、下丘脑等, 逐级传入中枢水平, 基于此, 有学者曾提出穴位-脑区相关理论来解释针刺效应[24,25,26]。
在中枢水平中, LHA是下丘脑核团间联接的桥梁[27], 能够接收并且整合内外感受器传递的信息, 同时还能够接收并且其他核团的神经信号[28]。可见, LHA在参与针刺不同穴位调节胃肠的过程, 并非单纯地表现为“有”或“无”现象。本研究也证实在GD和针刺刺激后, LHA神经元放电呈现兴奋和抑制两种效应, GD敏感神经元的活动在调节胃运动时具有重要作用。有研究发现, LHA同迷走神经复合体 (dorsal vagal complex, DVC) 存在神经通路, LHA-DVC参与调控GD敏感神经元活动及胃运动和胃酸分泌[29,30]。此外, 弓状核 (arcuate nucleus, Arc) 与LHA也存在纤维投射, 通过电刺激LHA发现, LHA-Arc改变GD敏感神经元活动[31], 从而影响胃肠功能。此外, 本课题组前期的研究结果也发现, 足三里、曲池、胃俞及中脘穴对于小脑顶核 (fastigial nucleus, FN) 的调节作用亦不相同, 而FN是小脑-下丘脑投射的起源核团之一, 针刺信号通过LHA-FN环路调节不同类型GD神经元改善胃肠运动[32]。由此可见, LHA对于不同的针刺信号传递及调节, 可能与其他相连核团密切相关从而使作用复杂化。其中, 胃俞在调节GD敏感神经元时, 既可以兴奋GD兴奋性神经元, 亦可抑制GD抑制性神经元, 从而在改善胃功能时发挥优势作用。
LHA是参与针刺调节胃功能的重要中枢核团之一。然而, 针刺调节胃功能的中枢整合机制复杂, 参与核团众多, 且与机体不同的状态有关。因此, 对针刺调节胃运动的中枢机制的探讨仍有很多需要深入研究的内容。
来源:中华中医药杂志 作者:梁超 王媛 徐斌 余芝